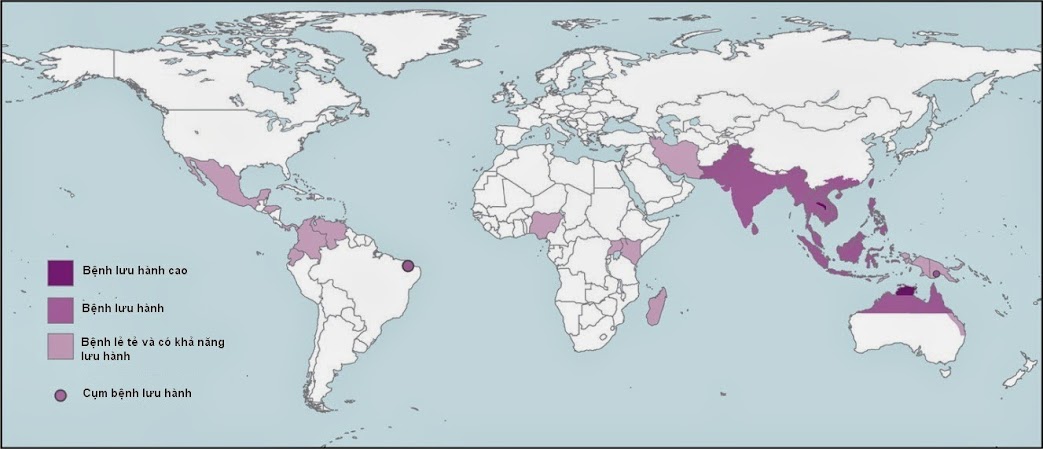
Melioidosis, do trực khuẩn Gram âm Burkholderia pseudomallei tồn tại trong môi trường tự nhiên gây ra, đặc điểm lâm sàng kinh điển là gây viêm phổi và áp xe đa ổ, có tỷ lệ tử vong đến 40%. Trực khuẩn này là nguyên nhân gây nhiễm khuẩn toàn thân quan trọng ở các cộng đồng cư dân ở Đông Nam Á và phía Bắc Úc. Người ta cho rằng sự phân bố toàn cầu của tác nhân gây bệnh này đang lan rộng, một mặt là nhờ những cải thiện về chẩn đoán vi sinh học, mặt khác là do số người đi du lịch và sự trở về của các nhân viên quân sự đến các vùng bệnh lưu hành ngày càng tăng (Hình.1)
VI KHUẨN
B. pseudomallei thuộc giống burkholderia, gồm có > 40 loài (species). Các thành viên gây bệnh khác gồm B. mallei - tác nhân gây bệnh sưng hạch ở ngựa và các loài thú có móng khác (loài ngựa, loài lừa) và có độc tính cao đối với con người và B. cenocepacia - một tác nhân gây nhiễm khuẩn cơ hội quan trọng ở các bệnh nhân mắc chứng xơ hóa nang (cystic fibrosis). Giống này cũng gồm B. thailandensis, một tác nhân cùng có mặt với B. pseudomallei trong đất đai ở Thái lan, Úc và B. oklahomensis, tác nhân được tìm thấy ở miền Trung - Tây Hoa Kỳ; hai loài hiếm này, chắc rằng gây bệnh và ít độc lực hơn nhiều (bằng một yếu tố >100.000) so với B. pseudomallei ở chuột hamsters và chuột nhắt.
MỘT BỘ GENE BIẾN THIÊN VÀ TIẾN HÓA CAO
Bộ gene B. pseudomallei tương ứng gồm hai cặp chromosomes 4,07 và 3,17 megabase, cho đến nay nó là một trong số các bộ gene di truyền của vi khuẩn phức tạp nhất đã được giải mã. B. pseudomallei có chung một tập hợp tâm 2.590 genes với các thành viên khác của giống burkholderia và là tính động học cao. Có 86% bộ mã gene di truyền B. pseudomallei K96243 dạng tiền type hay gặp nhất trong tất cả các dòng (strains) và đại diện bộ mã gene di truyền vùng tâm (core genome), có 14% thay đổi hiện diện trong tất cả các chủng phân lập. Miền có thể biến thiên gồm nhiều đảo (island) của bộ gene di truyền chứa DNA lấy được từ các vi khuẩn khác. Các cụm gene của bộ mã di truyền liên quan đến tính chất gây độc thích hợp có một tiềm năng nhiễm khuẩn, mặc dầu những kết hợp cụ thể với các kết cục lâm sàng chưa được hiểu rõ. Việc định type gene của nhiều khuẩn lạc (colonies) B. pseudomallei từ một số vị trí mô ở 4 bệnh nhân mắc melioidosis cấp tính đã cho thấy tính đa dạng di truyền đáng kể ở một bệnh nhân duy nhất, biểu thị năng lực của vi khuẩn để tiến hóa nhanh bên trong cơ thể vật chủ.
CÁC YẾU TỐ ĐỘC TÍNH
Nhiều yếu tố gây độc tiềm năng của B. pseudomallei đã từng được mô tả, nhưng tính chất quan trọng tương đối của mỗi yếu tố gây bệnh cho người vẫn chưa được biết đầy đủ. Hệ thống quorum - sensing ảnh hưởng đến yếu tố hành vi của toàn bộ quần thể vi khuẩn qua chất tiết ngoại bào của N-acyl homoserine lactones. B. pseudomallei chứa 3 nhóm(cluster) gene của hệ thống tiết type III (TTSS) mà mã hóa các đường hầm bắc cầu với màng tế bào (membrane-spanning syringes) để chuyển giao các phân tử hiệu lực của vi khuẩn vào bào tương tế bào vật chủ; hệ thống TTSS3, hệ thống kiểu Inv/Mxi-Spa, đóng vai trò quyết định ở nội bào của trực khuẩn bằng cách ảnh hưởng đến các tiến trình của vật chủ. Các đột biến TTSS3 gây bất thường sự sống sót nội bào của B. pseudomallei và ngăn cản sự lẫn tránh của vi khuẩn khỏi các hốc nội bào (endocytic vacuoles). Bộ mã di truyền của B. pseudomallei mã hóa 6 hệ thống tiết kiểu VI, mà liên quan tới độc tính của vi khuẩn, sự sống sót nội bào, và sự cạnh tranh với các cộng đồng vi khuẩn. Polysaccharide bao, lipopolysaccharide, và hai O-polysaccharides bề mặt khác (O-PS; types III O-PS và IV O-PS) là những yếu tố độc tính được phát hiện thêm. Roi (flagella) có thể có tính chất quan trọng đối với sự di chuyển và xâm nhập tế bào vật chủ của B. pseudomallei, mặc dầu sự quan trọng của nó như là một yếu tố độc tính trong bệnh sinh ở người đang được bàn cãi. Yếu tố 1 gây tử vong của Burkholderia tương tự với yếu tố 1 gây hoại tử độc tế bào của Escherichia coli và giao thoa với sự khởi đầu dịch mã, làm cho sự biến đổi actin của sườn tế bào và cuối cùng gây chết tế bào.
SỨC DỀ KHÁNG CỦA VẬT CHỦ CHỐNG LẠI B. PSEUDOMALLEI


Hình 2. Bệnh sinh miễn dịch của melioidosis.
B. pseudomallei cũng có thể gây cảm ứng,
sự hình thành các tế bào phì đại đa nhân.
Hoạt động nội bào
B. pseudomallei có thể xâm nhập, sống, và nhân lên ở cả tế bào thực bào lẫn tế bào không thực bào, và hoạt động nội bào của nó được xem là quan trọng đối với tính chất sinh bệnh. Sau khi vào nội bào, vi khuẩn này có thể lẫn tránh hốc thực bào và nhân lên bên trong cytosol của tế bào vật chủ. Rồi B. pseudomallei có thể gây cảm ứng các đuôi actin được tổng hợp từ những sợi actin mà trở nên bị phân cực và cho phép chuyển động bên trong tế bào, với sự hình thành kế tiếp của các nhú ra màng tế bào và trực chỉ lan tỏa vi khuẩn từ tế bào này đến tế bào khác (Hình 2).
Burkholderia pseudomallei có thể xâm nhập đại thực bào và rồi có thể sống sót và nhân lên trong suốt những thời kỳ dài. Mặc dầu một số vi khuẩn bị phá hủy sau khi bị thực bào, một số khác thoát khỏi các hốc tiêu khuẩn nội bào hoặc trực tiếp bị phá vỡ ở khoang ngoại bào hoặc nhiễm vào các tế bào khác thông qua sự nhú màng trên cơ sở cấu tạo actin. Các thụ thể Toll-like (TLRs) được biểu thị ở các tế bào vật chủ là phát hiện trước tiên cho sự xâm nhập của B. pseudomallei, làm cho yếu tố nhân κB (NF-κB) gây cảm ứng sự hoạt động của đáp ứng miễn dịch thông qua việc giải phóng các cytokine tiền viêm. Đáp ứng TLR được điều hòa một cách chặt chẽ: khởi động thụ thể được biểu thị trên các tế bào 1 dòng tủy (triggering receptor expressed on myeloid cells 1: TREM-1) khuếch đại các tín hiệu gây cảm ứng TLR, và phân tử giống như kinase được kết hợp với thụ thể của interleukin 1 (IRAK) (IRAK-M) làm giảm đáp ứng miễn dịch suốt quá trình mắc melioidosis. Các thụ thể túi viêm nội bào (intracellular inflammasome receptors), đáng chú ý nhất, các thụ thể giống như nucleotide-binding oligomerization domain (NOD) (NLRs) NLRC4 và NLRP3, phát hiện các yếu tố độc của vi khuẩn và các tín hiệu nội sinh nguy hiểm, dẫn đến việc giải phóng interleukin-1β và interleukin-18 qua trung gian caspase 1, bên cạnh hiện tượng pyroptosis (chết tế bào lệ thuộc caspase làm hạn chế sự tăng trưởng vi khuẩn nội bào). Interleukin-18 gây cảm ứng thêm nữa sự sản xuất interferon-γ có tính chất bảo vệ. Bạch cầu đa nhân trung tính được tuyển mộ hướng tới vị trí nhiễm khuẩn, và các dòng thác bổ thể và dòng thác đông máu bị hoạt hóa. Khi sự nhiễm khuẩn tiến triển, đáp ứng miễn dịch mắc phải dẫn đến sự tụ tập các tế bào T góp phần trong việc sản xuất interferon-γ, làm tăng đáp ứng miễn dịch trung gian tế bào và sản xuất kháng thể của các tế bào B. Hầu hết dữ liệu trong mô hình này được bắt nguồn từ những nghiên cứu trong ống nghiệm và mô hình melioidosis trên động vật. Chết tế bào theo chương trình liên quan đến protein giống speck gồm vùng tuyển mộ caspase (ASC) được dùng như một phân tử thích ứng NLR, trái lại yếu tố 88 biệt hóa tế bào tủy (MyD88) được dùng như một phân tử thích ứng TLR trung tâm.
SỰ NHẬN DIỆN B. PSEUDOMALLEI VÀ ĐÁP ỨNG MIỄN DỊCH
Các thụ thể nhận diện mẫu hình, đặc biệt là các thụ thể toll-like (TLRs) và các thụ thể giống như nucleotide-binding oligomerization domain (NOD) (NLRs), trước tiên là để phát hiện tác nhân gây bệnh vào vật chủ, khởi đầu các đáp ứng miễn dịch, và hình thành sự kết nối quan trọng giữa miễn dịch bẩm sinh và miễn dịch đáp ứng. Các thụ thể của sự nhận diện hình mẫu phát hiện các yếu tố vận động được bảo tồn trong tác nhân gây bệnh được gọi là “các mẫu hình phân tử liên quan đến tác nhân gây bệnh” (PAMPs). B. pseudomallei biểu thị các PAMPs khác nhau, gồm lipopolysaccharide, peptidoglycan, flagella, TTSS, và DNA, mà được các TLRs khác nhau nhận diện, và các phân tử liên quan chẳng hạn như CD14 và MD2, mà có thể được điều hòa ngược ở bệnh nhân mắc melioidosis. Các biến thể gene thuộc miền TLR4 ở người được kết hợp với tính nhạy cảm với melioidosis. Liệu rằng lipopolysaccharide của các tín hiệu B. pseudomallei bởi các phương tiện của TLR2, giống như lipopolysaccharide của Legionella pneumophila và Leptospira interrogans, hoặc các phương tiện của TLR4, mà liên quan như là thụ thể đối với lipopolysaccharide hay không vẫn còn là chủ đề nghiên cứu cần được quan tâm nhiều. Điều thú vị, là chuột thiếu CD14 và thiếu TLR2 được gây cảm ứng melioidosis thực nghiệm có một sức bảo vệ vật chủ được cải thiện đáng kể, mà được phản ánh qua một lợi ích sống sót mạnh mẽ, trái lại chuột thiếu TLR4 không thể phân biệt với chuột type hoang dã liên quan đến sự phát triển nhanh chóng và sống sót của vi khuẩn.
B. pseudomallei cũng có thể hoạt hóa túi viêm trong đại thực bào (cytosolic inflammasome), một phức protein, lớn đã hình thành, trong số các loại khác, bằng NLRs NLRC4 và NLRP3, sự đồng nhất của chúng dẫn đến sự hoạt hóa của caspase 1 và nâng cao sự chín muồi của các cytokines tiền viêm, interleukin-1β và interleukin-18. Interleukin-18 đóng một vai trò bảo vệ suốt quá trình bệnh melioidosis thông qua hiện tượng gây cảm ứng interferon-γ, một cytokine quan trọng mà góp phần sự bảo vệ chống lại melioidosis. Bằng việc so sánh, interleukin-1β có thể đóng một vai trò độc hại bằng cách gây ra sự tuyển mộ bạch cầu đa nhân trung tính quá nhiều và thương tổn mô và bằng ức chế sự hoạt hóa đối với việc sản xuất interferon-γ (Hình 2). Sự hoạt hóacaspase 1 do B. pseudomallei gây cảm ứng thông qua NLRC4, một thụ thể đối với thành phần BsaK của TTSS3, dẫn đến đại thực bào chết một cách nhanh chóng, một tiến trình pyroptosis (chết tế bào lệ thuộc caspase hạn chế sự tăng trưởng vi khuẩn nội bào) được dùng như là một cơ chế đề kháng vật chủ nhằm hạn chế sự tăng trường của vi khuẩn ở nội bào.
Đáp ứng miễn dịch được bắt đầu bằng các thụ thể nhận diện mẫu hình dẫn đến sự tuyển mộ các bạch cầu đa nhân trung tính, đại thực bào, và các tế bào lympho hướng đến các vị trí nhiễm khuẩn. Mặc dầu sự tuyển mộ đa nhân trung tính không được tương hợp có thể là trở thành sự tàn phá, các bạch cầu đa nhân trung tính bị hoạt hóa đóng một vai trò quan trọng trong việc cản trở vi sinh vật sớm. Các nghiên cứu chuột khiếm khuyết tế bào đã cho thấy rằng các tế bào T, đặc biệt là các tế bào TCD4+, góp phần quan trọng trong cả miễn dịch bẩm sinh lẫn miễn dịch mắc phải trong việc chống nhiễm B. pseudomallei, mặc dầu không có sự kết hợp giữa nhiễm HIV và nguy cơ mắc melioidosis. Các cytokines tiền viêm, TNF - α và IL - 6, cả hai cytokine này bị điều hòa nghịch trong quá trình melioidosis, hoạt hóa quá trình đông máu trong melioidosis nặng. Tất cả 3 con đường chính bị liên quan đến, với việc nâng cao đồng thời các cơ chế tiền đông và bất thường các cơ chế kháng đông và các cơ chế tiêu fibrin. Hệ thống bổ thể, chịu trách nhiệm đối với việc bảo tồn ổn định nội môi của tế bào vật chủ và việc cố định vi khuẩn (opsonization) và việc loại trừ vi khuẩn, trở nên được hoạt hóa nhanh chóng và tiêu thụ nhanh chóng suốt quá trình nhiễm B. pseudomallei.
CÁC HÌNH THÁI BỆNH Ở NGƯỜI
Dịch tễ học
Trong số các khu vực chính ở đó melioidosis đang lưu hành, nơi tận cùng của lãnh địa phía Bắc Úc và đông bắc Thái Lan đại diện các điểm nóng về bệnh này, với tỷ lệ mới mắc hàng năm lên tới 50/100.000 dân (Hình 1). Melioidosis là nguyên nhân gây tử vong hay gặp hàng thứ 3 của bệnh nhiễm trùng ở đông bắc Thái Lan, chỉ đứng sau nhiễm HIV và Lao. Mã Lai, Sin ga po, Việt Nam, Cambodia, và Lào cũng là vùng bệnh lưu hành. Các báo cáo đã mỡ rộng vùng dịch lưu hành tới các vùng của bán lục địa Ấn Độ, nam Trung Quốc, Hong Kong, Đài Loan, các đảo khác nhau ở Thái Bình Dương và Ấn Độ Dương, những phần của châu Mỹ. Các trường hợp bệnh lẻ tẻ đã được báo cáo ở Nigeria, Gambia, Kenya, và Uganda, nhưng phạm vi bệnh ở châu Phi vẫn còn chưa được xác định chắc chắn.
Phạm vi melioidosis ở châu Mỹ đang còn được làm rõ. Hai trường hợp đã được báo cáo ở Hoa Kỳ mà người ta cho rằng bệnh nhân đã từng bị nhiễm ở Honduras. Melioidosis nặng ở Puerto Rico đã từng được mô tả ở một bệnh nhân mắc bệnh u hạt mãn tính và ở một bệnh nhân mắc bệnh đái tháo đường, cả hai bệnh nhân trên bị mắc bệnh vào mùa mưa. Các trường hợp melioidosis lẻ tẻ đã từng được báo cáo ở Ecuador, Guadeloupe, và Aruba, và sự xuất hiện melioidosis ở Brazil là một ví dụ về việc phát hiện bệnh tăng lên trong các khu vực ở đó bệnh đã được quan tâm chú ý và việc sử dụng các test chẩn đoán. Aruba đã là khu vực của một vụ dịch ở cừu, dê và lợn trong những năm của thập kỷ 1950 và có thể đã là nơi đối với một bệnh nhiễm mắc phải ở một đứa trẻ đã bị xơ hóa nang mà được trình bày mới đây mắc melioidosis ở Massachusetts. Những ổ sinh thái đặc biệt này của B. pseudomallei dường như thay đổi trong số những nơi ở đó melioidosis đang lưu hành, nhưng dữ liệu mới đây mà B. pseudomallei đang quần cư và đang bùng phát ở những phần gốc rễ và phần không gian của các bải cỏ bản địa và được nhập khẩu ở bắc Úc cung cấp nhận thức về dịch tễ học và tiềm năng phân tán toàn cầu của bệnh.
Biểu hiện lâm sàng
Melioidosis sơ bộ hay gặp ở những người thường tiếp xúc đều đặn với đất và nước. Nhiễm loài vi khuẩn này do xâm nhập qua da (ví dụ, có nghĩa một sự xâm nhập qua một thương tổn hoặc vết thương hở), hít phải (ví dụ, suốt mùa khí hậu khắc nghiệt hoặc do bất cẩn), hoặc nuốt phải (ví dụ, qua thực phẩm hoặc nước bị nhiễm) (Hình 3)
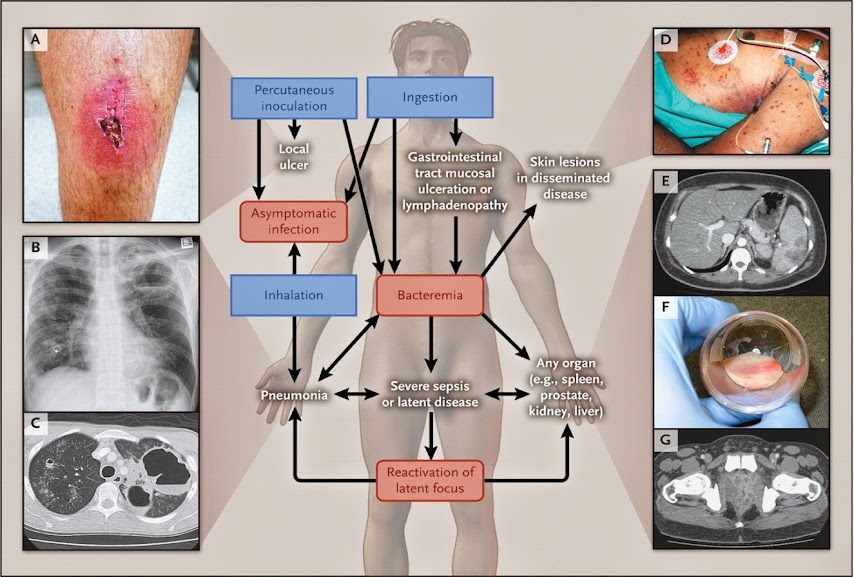

Hình3. Các biểu hiện lâm sàng sau khi nhiễm B. pseudomallei
Melioidosis có thể có một loạt các biểu hiện lâm sàng đa dạng, và mức độ nặng thay đổi từ một bệnh cảnh nhiễm khuẩn toàn thân bùng phát cấp tính đến một tình trạng nhiễm khuẩn mãn tính. Biểu thị các đường nhiễm (các ô xanh: xâm nhập qua da, xâm nhập do hít vào, và nuốt phải), các dạng lâm sàng (các ô đỏ: nhiễm không triệu chứng, nhiễm khuẩn máu, hoặc tái phản ứng của ổ nhiễm khu trú), và các biểu hiện đa dạng của bệnh (phần chữ không ô). Phần A biểu thị melioidosis da ở một vật chủ khỏe mạnh. Phần B biểu thị các áp xe ở phổi trên X quang lồng ngực của một bệnh nhân viêm phổi do melioidosis cấp tính, Phần C biểu thị hình ảnh phổi tương ứng với quét CT. Phần D biểu thị các biểu hiện da ở một trường hợp tử vong do melioidosis lan tỏa. Phần E biểu thị áp xe lách trên quét CT bụng. Phần F biểu thị mủ được hút ở một bệnh nhân áp xe tiền liệt tuyến và quanh tuyến tiền liệt, và phần G biểu thị các áp xe trên một quét CT của một bệnh nhân.
Melioidosis là bệnh chủ yếu theo mùa; 75% - 81% trường hợp xảy ra suốt mùa mưa. Tỷ lệ mới mắc cao nhất ở giữa 40 tuổi - 60 tuổi, nhưng cũng gặp melioidosis ở trẻ em. Melioidosis lây nhiễm đến trẻ con qua sữa mẹ từ những người mẹ bị viêm vú do tác nhân gây bệnh này.
Vì có đến 80% bệnh nhân mắc melioidosis có một hoặc nhiều yếu tố nguy cơ đối với bệnh này, mà người ta gợi ý rằng melioidosis được xem như một nhiễm khuẩn cơ hội mà kết cục không gây tử vong ở người trước đó khỏe mạnh, miễn là bệnh được chẩn đoán sớm và điều trị bằng kháng sinh thích hợp và có sẵn các nguồn lực chăm sóc, điều trị tăng cường. Các yếu tố nguy cơ đối với melioidosis gồm đái tháo đường (ở 23% - 60% bệnh nhân), nghiện rượu (ở 12% - 39%), bệnh phổi mãn tính (ở 12% - 27%), bệnh thận mãn tính (ở 10% - 27%), thalassemia (ở 7%), điều trị với glucocorticoid (<5%) và ung thư (<5%).
Thời kỳ ủ bệnh của melioidosis đã được đánh giá ở một nghiên cứu duy nhất đã được công bố, trong đó 25% bệnh nhân đã nhớ lại một biến cố cụ thể chẳng hạn như một chấn thương đã biểu hiện lâm sàng 1 - 21 ngày (trung bình 9 ngày) sau đó. Liều nhiễm, tính độc của dòng vi khuẩn, kiểu nhiễm và các yếu tố nguy cơ ở vật chủ là toàn bộ các yếu tố góp phần thích hợp đối với thời kỳ ủ bệnh, biểu hiện lâm sàng và kết cục. Một thời kỳ ủ bệnh 1 ngày hoặc ít hơn đã được xác định sau khi hít phải B. pseudomallei trong một trường hợp gần như chết đuối (near - drowning), trái lại thời kỳ ủ bệnh dài nhất đã ghi nhận rõ ràng là 62 năm.
Nhiễm B. pseudomallei có những biểu hiện lâm sàng phong phú, và độ nghiêm trọng thay đổi từ một nhiễm khuẩn toàn thân bùng phát cấp tính đến một nhiễm khuẩn mãn tính (sự có mặt các triệu chứng > 2 tháng, minh chứng cho 11% tất cả trường hợp) mà có thể giống như ung thư hoặc lao. Trong một nghiên cứu mô tả 540 bệnh nhân ở vùng nhiệt đới Úc trên một thời kỳ 20 năm, có hình thái lâm sàng ban đầu là viêm phổi (51% bệnh nhân), tiếp đến là nhiễm khuẩn tiết niệu (14%), nhiễm khuẩn da (13%), nhiễm khuẩn máu không có ổ nhiễm khu trú (11%), viêm khớp nhiễm khuẩn hoặc viêm xương tủy (4%) và liên quan đến thần kinh (3%) (Hình 3). Số còn lại 4% bệnh nhân không có bằng chứng nhiễm khuẩn khu trú. Hơn 1/2 bệnh nhân biểu hiện nhiễm khuẩn máu, và sốc nhiễm khuẩn phát triển gần 1/5 số trường hợp. Các áp xe cơ quan nội tạng và các ổ nhiễm thứ phát ở phổi, khớp, hoặc cả hai thì hay gặp.
Một biểu hiện khác biệt đáng lưu ý giữa các bệnh nhân ở miền nhiệt đới Úc và các bệnh nhân ở Đông nam Á là viêm tuyến mang tai sinh mủ, một bệnh cảnh có mặt lên đến 40% trường hợp do nhiễm melioidosis ở trẻ em Thái Lan và Cambodia nhưng lại cực kỳ hiếm ở Úc. Tại Úc, biểu hiện melioidosis ở tiền liệt tuyến chiếm gần 20% bệnh nhân nam và melioidosis thần kinh với biểu hiện viêm thân não, thường có mặt liệt thần kinh sọ (đặc biệt là dây VII), hoặc biểu hiện viêm tủy với biểu hiện yếu thần kinh vận động ngoại vi. Melioidosis tái phát xảy ra chừng 1/16 bệnh nhân, thường là năm đầu tiên sau lần biểu hiện lâm sàng lần đầu. Tính sơ bộ 1/4 trường hợp bệnh tái lại là do tái nhiễm, với số còn lại là do tái phát của một ổ nhiễm tồn tại dai dẵng. Tỷ lệ tử vong do melioidosis gần 40% ở vùng đông bắc Thái Lan (35% ở trẻ em) và 14% ở Úc.
CHẨN ĐOÁN VÀ TRỊ LIỆU
Một chẩn đoán chậm có thể gây tử vong, vì các chế độ kháng sinh trị liệu theo kinh nghiệm được dùng cho các trường hợp nghi ngờ nhiễm khuẩn toàn thân thường không bao phủ thỏa đáng đối với B. pseudomallei. Các hướng dẫn điều trị theo kinh nghiệm viêm phổi mắc phải tại cộng đồng ở các vùng dịch lưu hành khuyến cáo việc dùng các kháng sinh có hoạt tính chống lại B. pseudomallei ở các bệnh nhân có các yêu tố nguy cơ đối với melioidosis. Việc nuôi cấy B. pseudomallei từ một mẫu nghiệm lâm sàng bất kỳ là hết sức cần thiết đối với chẩn đoán melioidosis. Các thủ thuật cận lâm sàng cho việc nuôi cấy và nhận diện B. pseudomallei tối ưu đã được phát triển, nhưng mọi sự chậm trể về nhận diện B. pseudomallei hoặc một sự nhận diện sai thành ra các loài khác không phải là hiếm gặp trong các phòng xét nghiệm mà ở đó chưa quen biết với vi khuẩn này. Một thử nghiệm phản ứng chuỗi polymerase (PCR) trực tiếp của một mẫu nghiệm lâm sàng có thể cung cấp một kết quả xét nghiệm nhanh hơn kết quả nuôi cấy, nhưng thử nghiệm này ít nhạy cảm, đặc biệt khi được thực hiện trên máu. Kiểm định huyết thanh đơn thuần thì không thỏa đáng đối với việc xác minh chẩn đoán, đặc biệt ở trong các vùng bệnh lưu hành ở đó tỷ lệ huyết thanh (+) căn bản có thể > 50%. Nếu bắt đầu điều trị melioidosis và tiếp đến không phát hiện được B. pseudomallei trên các mẫu nghiệm nuôi cấy đầy đủ được lấy trước khi điều trị, thì nói chung người ta không khuyến cáo tiếp tục điều trị kháng sinh.
Melioidosis trải qua một quá trình có hại kéo dài; khó khăn điều trị dứt điểm nếu không có một quá trình dùng các kháng sinh kéo dài thích hợp. B. pseudomallei di truyền đề kháng với penicillin, ampicillin, các cephalosporin thế hệ 1 và 2, gentamicin, tobramycin, streptomycin, và polymyxin. Trong số các kháng sinh mới hơn, ertapenem, tigecycline, và moxifloxacin có một hoạt tính trong ống nghiệm hạn chế chống lại các chủng B. pseudomallei trên lâm sàng, và CMI đối với doripenem tương tự CMI đối với meropenem. Các cơ chế khác nhau đề kháng kháng sinh mắc phải đã từng được phát hiện, gồm các bơm đẩy thuốc ra (efflux pumps), bất hoạt enzyme, kháng sinh không thể thấm qua màng vi khuẩn, các thay đổi về vị trí đích tác dụng kháng sinh, và các thay đổi amino acid ở penA, mã hóa gene lớp A β-lactamase được bảo tồn cao.
Điều trị melioidosis gồm 2 giai đoạn, giai đoạn điều trị tấn công (intensive phase) ít nhất 10 - 14 ngày ceftazidime, meropenem, hoặc imipenem được dùng bằng đường tĩnh mạch, tiếp đến giai đoạn điều trị tiệt căn (eradication therapy) bằng kháng sinh đường uống, thường với trimethoprim - sulfamethoxazole (TMP-SMX) kéo dài 3 - 6 tháng (Bảng1)
Bảng 1. Điều trị melioidosis.*
|
Kháng sinh |
Liều lượng |
|
Điều trị khởi đầu mạnh mẽ ☼ |
|
|
Ceftazidime |
50 mg/kg (lên đến 2 g), 3 – 4 lần/ngày |
|
Meropenem |
25 mg/kg (lên đến 1 g), 3 lần/ngày |
|
Imipenem |
25 mg/kg (lên đến 1 g), 4 lần/ngày |
|
Điều trị đường uống tận gốc β |
|
|
TMP – SMX |
|
|
Trọng lượng cơ thể |
|
|
> 60 kg |
2 x 160 mg TMP - 800 mg SMX(viên 960 mg), mỗi 12 giờ/lần |
|
40 – 60 kg |
3 x 80 mg TMP - 400 mg SMX(viên 480 mg), mỗi 12 giờ/lần |
|
< 40 kg, người lớn |
1 x 160 mg TMP - 800 mg SMX(viên 960mg) hoặc 2 x 80 mg TMP - 400 mg SMX(viên 480mg), mỗi 12 giờ/lần |
|
< 40 kg, trẻ em |
8 mg TMP/kg - 40 mg SMX/kg, mỗi 12 giờ |
* Thông tin liều thuốc từ Peacock và cộng sự và Chetchotisakd và cộng sự.
☼ Định nghĩa điều trị mạnh mẽ khi dùng một trong những thuốc được liệt kê bằng đường tĩnh mạch trong một thời kỳ 10 - 14 ngày. Bốn hoặc trên 4 tuần điều trị đường tĩnh mạch có thể cần thiết cho các trường hợp bệnh nặng (ví dụ, những người tiếp tục sốc nhiễm khuẩn, các ổ áp xe định vị các nơi sâu hoặc cơ quan, bệnh phổi lan tỏa, viêm khớp nhiễm khuẩn, viêm xương tủy, hoặc melioidosis thần kinh). Bên cạnh TMP - SMX có sẵn với tỷ số liều thuốc cố định là 1 phần TMP với 5 phần SMX, tại liều 8 mg TMP và 40 mg SMX đối với mỗi kg cân nặng cơ thể (lên đến 320 mg TMP và 1.600 mg SMX) mỗi 12 giờ phải được cân nhắc cho bệnh nhân bị mắc melioidosis thần kinh, tuyến tiền liệt, xương, hoặc khớp. Một sự chuyển qua dùng meropenem được chỉ định nếu tình trạng lâm sàng xấu đi khi dùng ceftazidime (ví dụ, xuất hiện suy cơ quan), nếu một ổ nhiễm mới xuất hiện trong quá trình điều trị, hoặc cấy máu lại có kết quả (+) sau 7 ngày.
β Điều trị bằng đường uống được yêu cầu trong thời gian 3 – 6 tháng. Nếu vi khuẩn đề kháng với TMP - SMX hoặc bệnh nhân không thể chịu đựng các tác dụng ngoại ý trong việc đáp ứng với thuốc, chọn lựa thuốc thứ 2 là amoxicillin - clavunate và doxicilline. Liều amoxicilline - clavunate được khuyến cáo 20 mg amoxicillin và 5 mg clavunate mỗi kg cân nặng được dùng bằng đường uống, 3 lần/ngày.
Carbapenems, như meropenem và imipenem, có MIC thấp hơn và các kết quả cao trong các nghiên cứu thời gian, diệt khuẩn trong ống nghiệm hơn ceftazidime, nhưng trong một nghiên cứu ngẫu nhiên so sánh ở Thái Lan đã không thấy được một lợi ích sống còn của imipenem hơn ceftazidime. Khuyến cáo hiện nay đối với giai đoạn điều trị bằng đường uống là TMP - SMX, khuyến cáo này thay thế cho khuyến cáo trước đây để cho dùng thuốc này kết hợp với doxycycline. Khuyến cáo sự tìm kiếm cẩn thận đối với các áp xe cơ quan nội tạng, chẳng hạn như việc dùng CT để quét hoặc siêu âm ổ bụng và khung chậu. Điều trị thêm vào đối với các ổ áp xe gồm dẫn lưu các ổ mủ và chọc hút và rửa các ổ khớp bị nhiễm khuẩn.
Tỷ lệ đề kháng đối với TMP - SMX, như được đánh giá với việc dùng Etest (AB Biodisk), được báo cáo xấp xỉ 13% đối với các chủng được phân lập tại Thái Lan nhưng thấp hơn nhiều đối với các chủng được phân lập ở Úc (0 - 2,5%). Một thuốc thay thế để điều trị tiệt căn (eradication) là amoxicillin -clavulanate; mặc dầu hiệu lực của nó thấp hơn TMP - SMX vì nó được kết hợp với một tỷ lệ tái phát cao hơn, amoxicillin - clavulanate được dùng ở một số địa phương dành cho trẻ em và thai phụ. B. pseudomallei đề kháng với carbapenems chưa có tư liệu minh chứng, và sơ bộ đề kháng với ceftazidime là cực kỳ hiếm gặp. Trong các trường hợp rất hiêm, sự đề kháng mắc phải đối với ceftazidime xảy ra trong quá trình điều trị; các cơ chế đối với đề kháng mắc phải gồm các đột biến điểm và và sự khiếm khuyết gene.
PHÒNG NGỪA VÀ PHÁT TRIỂN VACCINE
Melioidosis là một bệnh có thể có tiềm năng phòng ngừa, nhưng chưa có cơ sở bằng chứng để phát triển các hướng dẫn phòng ngừa. Mặc dầu người ta khuyến cáo rằng người mắc chứng xơ hóa nang được cảnh báo về việc đi du lịch đến các vùng ở đó melioidosis đang lưu hành, nói chung người ta không có lời khuyên đối với các du khách, cho dù số lượng trường hợp bệnh đã tăng lên đối với các du khách, nhiều người trong số họ mắc bệnh đái tháo đường. Người ta khuyên những người có nhiều yếu tố nguy cơ chẳng hạn như đái tháo đường hoặc trị liệu bằng thuốc ức chế miễn dịch nên ở nhà suốt thời kỳ mưa gió nặng, lúc đó bụi có thể mang B. pseudomallei. Chưa có bằng chứng để hỗ trợ cho việc bệnh lây từ người sang người qua đường hô hấp. Hiện nay chưa có vaccine melioidosis, nhưng đây là một lãnh vực nghiên cứu tích cực trên các mô hình động vật liên quan đến việc sử dụng vaccine dự tuyển sống giảm độc lực, tiểu đơn vị, DNA trên căn bản plasmid, và vaccine dự tuyển vi khuẩn đã bị diệt hoàn toàn. Chưa có vaccine dự tuyển đã từng được kết hợp với tính sinh miễn dịch làm vô khuẩn. Các khuyến cáo đối với dự phòng sau phơi nhiễm sau phơi nhiễm ở phòng thí nghiệm do bất cẩn đối với B. pseudomallei hoặc trong biến cố tai nạn giải phóng B. pseudomallei. Melioidosis đã từng được báo cáo sau ghép thận và việc phát hiện đang tăng lên ở các bệnh nhân tiếp nhận thuốc điều trị ức chế miễn dịch, đặc biệt glucocorticoids liều cao. Việc tiếp cận với điều trị bệnh nhân bị ức chế miễn dịch là khi bắt đầu trị liệu ức chế miễn dịch và không triệu chứng nhưng có bằng chứng phơi nhiễm về huyết thanh.
TÓM TẮT
Nói chung, nhờ cải thiện chẩn đoán vi sinh và việc chú ý đến bệnh của nhân viên y tế, việc phát hiện và báo cáo trường hợp melioidosis ngày càng tăng trên thế giới. So sánh với Úc, tỷ lệ tử vong ở Thái Lan cao hơn, gợi ý rằng những cố gắng để giảm tỷ lệ tử vong phải được hướng đến những nơi mà nguồn nhân lực bị hạn chế, với một nhấn mạnh đến việc dùng kháng sinh sớm, phát hiện nhiễm khuẩn toàn thân sớm và hồi sức dịch thỏa đáng. Việc giảm thiểu thêm nữa tỷ lệ tử vong ở các khu vực còn thiếu thốn cơ sở vật chất y tế hiện đại và việc cải thiện có thể chỉ còn một cách là tùy thuộc vào chiến lược điều trị mới từ nghiên cứu cơ bản về bệnh sinh vi khuẩn và các tương tác giữa tác nhân gây bệnh, vật chủ.
Theo NEJM (New England Journal Medicine)



