Hiện nay dịch Ebola virus xuất hiện ở châu Phi làm cho nhiều người mắc bệnh và tử vong. Năm 2014, bệnh đã xảy ra ở Guinea, Sierra Leone và Liberia. Để cung cấp thông tin về bệnh, Tạp chí “Truyền nhiễm Việt Nam” đã sưu tầm và dịch một số tài liệu của CDC (Hoa Kỳ) đã chính thực được phát hành. Xin gửi đến các đồng nghiệp và bạn đọc tham khảo, nhằm hỗ trợ việc cập nhật những thông tin cơ bản về bệnh virus này.
Đại cương
Ebola virus là một tác nhân của ít nhất 30 virus đã được biết có khả năng gây ra hội chứng sốt xuất huyết. Toàn bộ chúng được phát hiện ngày nay là những RNA virus có một lớp vỏ lipid, tất cả được xem là tác nhân gây bệnh ở động vật, tất cả đều gây thương tổn vi mạch (cuối cùng tăng thấm mạch máu) và tất cả là những thành viên của 1 trong 4 họ sau:
- Arenaviridae.
- Bunyaviridae.
- Flaviviridae.
- Filoviridae.
Mặc dầu một số virus sốt xuất huyết thường lan truyền qua trung gian ve mò (ticks) hoặc muỗi; ngoại trừ virus dengue gây sốt xuất huyết, tất cả đều có khả năng lan truyền qua giọt nước bọt và do khả năng này chúng có tiềm năng trở thành các tác nhân “khủng bố sinh học”.
Họ Filoviridae nằm trong lớp (order) Mononegavirales và chứa bộ mã di truyền lớn nhất trong lớp này. Họ này có 2 giống (genera): Ebolavirus (chứa 5 loài (species) và khác biệt về mặt kháng nguyên với Marburgvirus (chỉ có một loài duy nhất).
Ở bệnh nhân phơi nhiễm với Ebola virus nguyên phát (có mặt ở vùng Ebolavirus lưu hành) hoặc thứ phát (lây truyền người qua người hoặc từ loài linh trưởng đến người). Các dấu hiệu thực thể tùy vào giai đoạn của bệnh ở thời điểm thăm khám.
Các nghiên cứu đã cho thấy bệnh nhân tử vong do nhiễm Ebolavirus không có đáp ứng miễn dịch thể dịch. Trái lại, người còn sống có thể phát hiện được kháng thể trung hòa. Điều này cho thấy một đáp ứng miễn dịch thể dịch rộng có thể tăng khả năng chống lại bệnh.
Hiện chưa sẵn có thuốc đặc trị và vaccine phòng ngừa sốt xuất huyết do Ebolavirus. Do đó, điều trị hỗ trợ là quan trọng. Việc chăm sóc, quản lý với hàng rào cách ly nghiêm ngặt. Vì chưa biết được nguồn gốc xuất phát của Ebola virus, nên việc truyền bá kiến thức và phòng ngừa cho các trường hợp sơ nhiễm còn là một vấn đề nan giải. Truyền bá kiến thức cho cộng đồng về nguy cơ, đặc biệt là nhân viên y tế, có thể giảm được số lượng rất lớn trường hợp lây nhiễm thứ phát từ người sang người.
Về thông tin hiện nay (2014) dịch Ebola virus ở châu Phi xảy ra ở Guinea, Sierra Leone và Liberia (xem phần Dịch tễ học). Vụ dịch hiện nay đã thúc đẩy CDC Hoa Kỳ phát hành một lời tư vấn cấp 2 về việc du lịch tới Sierra Leone, Guinea và Liberia, thông báo cho các người sẽ đi du lịch nâng cao việc cảnh giác, tránh tiếp xúc với máu và các dịch cơ thể của người đã bị nhiễm Ebola virus.
Sinh lý bệnh và căn nguyên
Siêu cấu trúc và bệnh sinh
Các thành viên được biết của họ Filoviridae là giống Ebolavirus và Marburgvirus. Theo phân loạicủa Ủy ban Phân loại Virus Quốc tế, năm 2012, Ebolavirus có 5 loài riêng biệt:
1. Sudan ebolavirus.
2. Zaire ebolavirus.
3. Tai Forest ebolavirus (trước đây thường gọi Ivory Coastebolavirus hoặc Côte d’Ivoireebolavirus).
4. Reston ebolavirus.
5. Bundibugyo ebolavirus.
Filoviruses chẳng hạn như Ebola virus có chung dạng đặc điểm hình sợi, có một đường kính ngang đều xấp xỉ 80 nm, nhưng độ dài khác nhau. Các dạng hình sợi có thể thẳng, thường chúng cuộn lại (hình dưới).
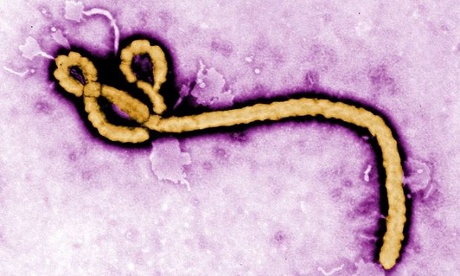
Hình ảnh Ebola virus dưới kính hiển vi điện tử (Theo Frederick Murpy/CDC/EPA)
Ebola virus có một bộ mã di truyền RNA chuỗi âm không phân đoạn chứa 7 genes cấu trúc và điều hòa. Bộ mã di truyền của Ebola mã hóa cho 4 proteins cấu trúc của hạt virus (VP30, VP35, nucleoprotein và một polymerase protein [L]) và 3 proteins kết hợp màng (VP40, glycoprotein [GP], và VP24). Gene GP được định vị thứ 4 từ 3′ cuối của 7 gene được sắp xếp tuyến tính.
Sau nhiễm, người và loài linh trưởng không phải người trải qua một thời kỳ virus nhân lên sớm, trong các trường hợp tử vong, được kết hợp với một đáp ứng miễn dịch không hiệu lực. Mặc dầu bệnh sinh đã được làm sáng tỏ nhưng cần điều tra thêm để có sự hiểu biết đầy đủ hơn về bệnh Ebola virus.
Hầu hết protein của filovirus được mã hóa trong các sườn đọc đơn; glycoprotein bề mặt được mã hóa trong 2 sườn (sườn đọc mở [ORF] I và ORF II). ORF I (phần tận mang amino acid) của các mã hóa gene cho một glycoprotein tiết thải nhỏ (50-70kd), hòa tan, không cấu trúc (secretory glycoprotein: sGP), chúng được sản xuất những lượng lớn trong giai đoạn nhiễm Ebola virus sớm.
sGP gắn với CD16b của bạch cầu đa nhân trung tính, một thụ thể III Fcg đặc hiệu của bạch cầu đa nhân trung tính và ức chế sự hoạt hóa bạch cầu đa nhân trung tính sớm. sGP cũng có thể chịu trách nhiệm đối với việc giảm lượng tế bào lympho nặng nề đó là đặc điểm nhiễm Ebola virus. Do đó, người ta tin rằng sGP đóng những vai trò chủ yếu về năng lực của Ebola virus để ngăn cản một đáp ứng miễn dịch vật chủ hiệu lực sớm. Một giả thuyết cho rằng Marburg virus thiếu sự sản xuất sGP, điều này có thể giải thích lý do tại sao nó ít độc hơn Ebola virus bắt nguồn từ châu Phi.
Leroy và cộng sự đã báo cáo sự quan sát của họ về 24 người tiếp xúc gần gũi với bệnh nhân có triệu chứng do bị nhiễm Ebola virus nặng. 11/24 người tiếp xúc đã có bằng chứng bị nhiễm virus không triệu chứng được kết hợp với sự nhân lên của virus. Các tác giả đã chứng minh được sự nhân lên của virus qua phương pháp khuếch đại chuỗi xoắn dương RNA của Ebola virus lấy từ máu của người tiếp xúc không triệu chứng.
Một nghiên cứu chi tiết về những người nhiễm không biểu hiện triệu chứng này đã cho biết rằng họ có (4 – 6 ngày sau nhiễm) đáp ứng miễn dịch sớm và mạnh mẽ có sự sản xuất IL–1β, IL-6 và TNF, kết quả của miễn dịch qua trung gian tế bào và qua trung gian thể dịch đã được nâng cao. Ở các bệnh nhân cuối cùng bị tử vong, đã không phát hiện được các cytokines tiền viêm, thậm chí sau 2 – 3 ngày nhiễm có biểu hiện triệu chứng.
Thứ hai, glycoprotein lớn hơn một chút (120 – 150kd), glycoprotein xuyên màng được kết hợp trong hạt Ebola virus và gắn với các tế bào nội mạc mạch máu, nhưng lại không gắn với bạch cầu đa nhân trung tính. Người ta biết được Ebola virus xâm nhập, nhân lên trong tế bào nội mạc mạch máu và cuối cùng phá hủy các tế bào này. Sự phá hủy bề mặt các tế bào nội mạc mạch máu liên quan đến đông máu rải rác nội mạch (DIC) và điều này có thể góp phần với các biểu hiện xuất huyết mà là đặc điểm của nhiều trường hợp nhưng không phải tất cả các trường hợp nhiễm Ebola virus.
Nhiễm bệnh biểu hiện lâm sàng ở người và loài linh trưởng không phải người được kết hợp với sự nhân lên virus lan tỏa và nhanh chóng trong tất cả các mô. Sự nhân lên của virus được kèm theo bằng hoại tử lan tỏa và khu trú nặng. Hầu hết các hoại tử nặng xảy ra ở gan và hoại tử kèm theo với sự hình thành các thể giống thể Councilman tương tự với những thể gặp phải trong bệnh sốt vàng. Ở các trường hợp nhiễm virus đưa đến tử vong, các mô của vật chủ và máu chứa lượng lớn Ebola virus hoàn chỉnh và các mô và dịch cơ thể có tính lây nhiễm rất cao.
Năm loài Ebolavirus được gọi tên theo các địa phương ở đó chúng gây bệnh cho người hoặc động vật có tư liệu bằng chứng. Hai loài châu Phi, Sudanebolavirus và Zaireebolavirus, chịu trách nhiệm đối với hầu hết các trường hợp tử vong đã được báo cáo. Bệnh do Ebola virus bắt nguồn từ châu Phi biểu hiện lâm sàng nặng và chỉ trừ một bệnh nhân bị nhiễm (hiện còn sống) với một loài virus châu Phi thứ ba đó là Ivory Coast ebolavirus, được kết hợp một biên độ tỷ lệ tử vong từ 65% (Sudan, năm 1979) đến 89% (Cộng hòa Dân chủ Congo [DRC], tháng 12/2002 đến tháng 4/2003).
Một loài Ebolavirus thứ tư là Reston ebolavirus, lần đầu tiên được phân lập vào năm1989 ở những con khỉ được nhập khẩu từ một công ty xuất khẩu duy nhất của Philippines. Một chủng hầu như giống hệt được nhập khẩu cùng cơ quan xuất khẩu của Philippines đã được phát hiện ở Siena, Italy vào năm 1992. Đến nay, loài này chưa có tư liệu minh chứng gây bệnh cho người.
Loài Ebolavirus thứ năm, cũng là dòng ở châu Phi, đó là Bundibugyo ebolavirus, nó đã gây một vụ dịch ở Uganda trong năm 2007-2008, với tỷ lệ tử vong 25%.
Giữa năm 1994 và 1997, một dòng (strain) Ebola virus ổn định đã gây ra ba vụ dịch sốt xuất huyết liên tiếp ở Gabon (tỷ lệ tử vong 60-74%). Vì dòng Gabon có chung sự đồng nhất > 99% của nucleoprotein và các miền gene GP với Zaireebolavirus, do đó chưa được xem là một loài khác biệt.
Nơi thích hợp đối với filoviruses đã được phát hiện. Năm 1996, các thành viên Viện Virus học Quốc gia Nam Phi đến vùng Kikwit, Cộng hòa Dân chủ Congo (DRC) và đã đánh giá tính lây nhiễm của Ebola virus đối với 24 loài cây, 19 loài động vật xương sống và động vật không xương sống. Loài dơi ăn côn trùng và loài dơi ăn trái cây đã được tìm thấy hổ trợ cho sự nhân lên Ebola virus mà không chết. Thêm vào đó, chuẩn độ Ebola trong huyết thanh ở loài dơi ăn trái cây bị nhiễm cao chừng 106 đơn vị hình thành điểm phát huỳnh quang/mL (fluorescent focus-forming units/mL) và phân của chúng chứa Ebola virus còn sống.
Cơ chế của sự lan truyền virus
Nhiễm filovirus bắt nguồn từ châu Phi có đặc điểm là sự lây truyền từ một vật chủ chưa được biết (có thể là dơi) đến người hoặc đến các loài linh trưởng không phải người, giả định qua đường tiếp xúc trực tiếp với các dịch cơ thể chẳng hạn như nước bọt, hoặc máu, hoặc các mô cơ thể bị nhiễm khác. Chứng cớ ở loài linh trưởng không phải người biểu thị rằng Sudan ebolavirus và Zaire ebolavirus có thể được lây truyền bằng tiếp xúc với các màng nhày, kết mạc, hầu (họng) và bề mặt đường tiêu hóa; qua các vết rách nhỏ ở da; Và tối thiểu là qua thực nghiệm, bằng các giọt nước bọt nhỏ qua đường thở (aerosol).
Người ta từng thấy chó nhiễm Ebola virus không biểu hiện triệu chứng, có thể do tiếp xúc với những giọt nước tiểu, phân, hoặc máu của các vật chủ chưa được biết rõ chứa đầy virus. Về ý nghĩa dịch tễ học là sự quan sát rằng các tỷ lệ hiện mang huyết thanh dương tính (seroprevalence) ở chó tăng lên theo một hình thái tuyến tính khi lấy mẫu ở các khu vực được tiếp cận các trường hợp người mắc bệnh, đạt tỷ lệ cao chừng 31,8%. Do đó, một sự tăng lên tỷ lệ hiện mang huyết thanh dương tính của loài chó có thể xem như một chỉ số về sự lưu hành tăng lên của Ebola virus ở các vật trung gian nguyên phát (primary vectors) trong các khu vực địa lý cụ thể.
Nhiễm ở người với những chủng virus bắt nguồn từ châu Phi đã từng xảy ra ở người chăm sóc bệnh nhân (người nhà, nhân viên y tế) và các thành viên gia đình chuẩn bị khâm liệm cho người thân chết trước khi chôn. Các giai đoạn muộn của bệnh Ebola virus được kết hợp với sự hiện diện những số lượng lớn các hạt virus hoàn chỉnh trong các loại dịch cơ thể, các mô và đặc biệt là da. Những cá nhân phơi nhiễm với bệnh nhân bị nhiễm Ebola virus không có hàng rào bảo vệ thích hợp và có nguy cơ bị nhiễm cao.
Một báo cáo từ Cộng hòa Dân chủ Congo (DRC) đã phát hiện RNA của Ebola virus ở 100% của các chất tiết từ miệng bệnh nhân, mà các bệnh nhân này có RNA virus trong huyết thanh của họ. Cả huyết thanh lẫn dịch tiết từ miệng đã được kiểm định với thử nghiệm RT-PCR. Vì vậy, các chất tiết từ miệng có thể là khả năng của sự lây truyền Ebola virus.
Vụ dịch được báo cáo đầu tiên xảy ra năm 1976 ở Yambuku thuộc Cộng hòa Dân chủ Congo, nơi có 316 bệnh nhân bị nhiễm. Trong một vụ dịch ở thành phố được báo cáo lớn nhất cho đến nay (DRC, 1995; 318 trường hợp), bệnh nhân vào viện đã làm khuếch đại tần số lây truyền lớn nhất. Thiếu hàng rào bảo vệ nghiêm ngặt, việc dùng và tái dùng các thiết bị y tế bị nhiễm, đặc biệt là kim và bơm tiêm, đã làm cho sự nhiễm bệnh lan rộng tại bệnh viện một cách nhanh chóng. Chỉ sau khi có hàng rào bảo vệ thỏa đáng và thay đổi việc thực hiện các quy định về việc chôn cất bệnh nhân tử vong thì vụ dịch này mới được chặn đứng.
Khác với Ebola virus bắt nguồn từ châu Á (Restonebolavirus, được nêu trên), các loài bắt nguồn từ châu Phi hình như thường lan tỏa bằng con đường tiếp xúc trực tiếp hơn là qua đường hô hấp. Tuy nhiên, các loài Reston đã được thể hiện một cách lặp lại để lan tỏa trong số các loài linh trưởng không phải người và có thể từ các loài linh trưởng đến người qua đường hô hấp. May thay, mặc dầu loài Reston đã được minh chứng bằng tư liệu có khả năng lây nhiễm ở người, mà dường như nó không sinh bệnh ở người.
Dịch tễ học
Có tư liệu bằng chứng rõ nét Ebola và Marburg viruses chịu trách nhiệm các vụ dịch sốt xuất huyết nặng ở người, với trường hợp kết cục tỷ lệ tử vong từ 23% đối với nhiễm Marburg virus đến 89% đối với nhiễm Ebola virus trong đó hơn 1 trường hợp đã xảy ra (Bảng 1, 2, 3, 4, và 5 bên dưới).
Hiện nay (2014) vụ dịch Ebola virus có ý nghĩa và sơ bộ liên quan đến 3 nước châu Phi là Guinea, Liberia, và Sierra Leone. Kể từ 23 tháng 7 năm 2014, toàn bộ 1.201 trường hợp bị nghi ngờ hoặc được xác minh (814 trường hợp được xác định bằng xét nghiệm) đã được báo cáo ở các nước này, kết quả là 672 trường hợp tử vong. Dựa lên phân tích di truyền, virus giống 97% đối với Zaire ebolavirus đã được phân lập mới đây (đầu năm 2014) những trường hợp ở Gabon và Cộng hòa Dân chủ Congo. Ít nhất có 3 người Mỹ ở châu Phi đã bị nhiễm Ebola virus trong vụ dịch hiện nay, một người trong số đó đã tử vong vì bệnh này.
Bảng 1. Lịch sử các vụ dịch do Sudan Ebola Virus gây ra
|
Năm |
Nơi xảy ra |
Số ca |
Số tử vong (%) |
|
1976 |
Sudan |
284 |
151 (53) |
|
1976 |
England* |
1 |
0 (0) |
|
1979 |
Sudan |
34 |
22 (65) |
|
2000-2001 |
Uganda |
425 |
224 (53) |
|
2004 |
Sudan |
17 |
17 (41) |
|
2011 |
Sudan |
1 |
1 (100) |
|
Tổng: |
|
762 |
405 (53) |
Dữ liệu của CDC và WHO. *Đã xảy ra sau tai nạn phòng thí nghiệm.
Bảng 2. Lịch sử các vụ dịch do Zaire Ebola Virus gây ra
|
Năm |
Nơi xảy ra |
Số ca |
Số tử vong (%) |
|
1976 |
Zaire |
318 |
280 (88) |
|
1977 |
Zaire |
1 |
1 (100) |
|
1994 |
Gabon |
52 |
31 (60) |
|
1995 |
DRC* |
315 |
250 (81) |
|
1/1996 đến 1/1996 |
Gabon |
37 |
21 (57) |
|
7/1996 đến 1/1997 |
Gabon |
60 |
45 (74) |
|
1996 |
Nam Phi (bị nhiễm ở Gabon) |
1 |
1 (100) |
|
10/2001 đến 3/2002 |
Gabon |
65 |
53 (82) |
|
10/2001 đến 3/2002 |
DRC |
59 |
44 (75) |
|
12/2002 đến 4/2003 |
DRC |
143 |
128 (89) |
|
11/2003 đến 12/2004 |
DRC |
35 |
29 (83) |
|
2007 |
DRC |
264 |
187 (71) |
|
12/2008 đến 2/2009 |
DRC |
32 |
15 (47) |
|
7/2012 |
Uganda |
24 |
17 (71) |
|
11/2012 |
DRC |
77 |
36 (46) |
|
12/2012 |
Uganda |
7 |
4 (57) |
|
Tổng: |
|
1.490 |
1.141 (76.6) |
Dữ liệu của CDC và WHO;
DRC*: Democratic Republic Congo: Cộng hòa Dân chủ Congo.
Bảng 3. Lịch sử các vụ dịch do Tai Forest (Ivory Coast, Côte-d’Ivoire) Ebola Virus gây ra (không báo cáo ca tử vong)
|
Năm |
Nơi xảy ra |
Báo cáo ca bệnh |
|
1994 |
Côte-d’Ivoire |
1 |
|
Tổng |
|
1 |
Dữ liệu của CDC và WHO.
Bảng 4. Lịch sử các vụ dịch do Reston Ebola Virus gây ra
(không báo cáo ca tử vong)
|
Năm |
Nơi xảy ra |
Số ca báo cáo được chứng minh* |
|
1989 |
Bang Virginia, Texas, Pennsylvania |
0 |
|
1990 |
Bang Virginia và Texas |
4 |
|
1989-1990 |
Philippines |
3 |
|
1992 |
Italy |
0 |
|
1990 |
Alice, TX |
0 |
|
1996 |
Philippines |
0 |
|
Nov 2008 |
Philippines† |
6 |
|
Tổng |
|
13 |
Dữ liệu của CDC và WHO.
*Người có bằng chứng nhiễm có biểu hiện huyết thanh không biểu hiện lâm sàng.
†Liên quan đến nông trại nuôi lợn.
Bảng 5. Lịch sử các vụ dịch do Bundibugyo Ebola Virus gây ra
|
Năm |
Nơi xảy ra |
Số ca báo cáo |
Số tử vong (%) |
|
12/2007 đến 1/2008 |
Uganda |
131 |
42 (37) |
|
Tổng: |
|
131 |
42 (37) |
Dữ liệu của CDC và WHO.
Những cá nhân được xem nguy cơ đối với sốt xuất huyết Ebola gồm người có một tiền sử du lịch đến cận sa mạc Saharan châu Phi, người đã chăm sóc người bệnh bị nhiễm mới đây và các công nhân làm việc với loài linh trưởng đã bị nhiễm các phó type Ebola virus có nguồn gốc từ châu Phi. Năm 2011, Uganda đã trải qua kinh nghiệm của sự tái nổi của bệnh này.
Tuổi mắc bệnh
Trong vụ dịch năm 1995 ở Kikwit, DRC, tỷ lệ nhiễm ở trẻ em thấp hơn người lớn có ý nghĩa. Suốt vụ dịch này, chỉ 27 (8,6%) trong số 315 bệnh nhân được chẩn đoán nhiễm Ebola virus ở tuổi ≤ 17 tuổi. Bệnh xảy ra ít ở trẻ em thậm chí mặc dầu 50% dân số của Cộng hòa Dân chủ Congo < 16 tuổi. Mặc dầu thiếu bằng chứng xác định, bằng chứng dịch tễ gợi ý rằng trẻ em ít tiếp xúc trực tiếp với bệnh nhân so với người lớn.
Giới mắc bệnh
Không có sự khác biệt về giới, nhưng có sự khác nhau giữa nam và nữ liên quan đến cách thức phơi nhiễm trực tiếp Ebola virus.
Namgiới hay làm việc trong các rừng già và vùng đồi cây thấp, có thể tăng cao nguy cơ mắc phải sơ nhiễm do thu thập thịt thú rừng, các xác loài linh trưởng để làm thức ăn, cũng như một trung gian hoặc nhiều trung gian truyền bệnh chưa được rõ. Chứng cớ từ châu Phi và Philippines tương hợp với loài dơi như một trung gian truyền bệnh chính của Ebola virus.
Vì nữ giới thường chăm sóc trực tiếp cho người nhà mắc bệnh và khâm liệm bệnh nhân tử vong, nên có nguy cơ cao nhiễm Ebola virus do tham gia các hoạt động này.
Trái lại, nam và nữ giới là nhân viên cung cấp dịch vụ y tế đều có chung một nguy cơ nhiễm cao và tương đương nhau.
Tiên lượng
Nhiễm Ebola virus có tiên lượng xấu. Tuy nhiên, người sống sót 2 tuần sau nhiễm sẽ có khả năng khỏi bệnh nhưng chậm.
Ngoại trừ chủng Reston, Ebola virus được kết hợp với tỷ lệ mắc và tỷ lệ tử vong cao trong số bệnh nhân có biểu hiện lâm sàng, mặc dầu những tỷ lệ này thay đổi tùy thuộc vào loài gây bệnh. Tỷ lệ tử vong cao nhất Zaireebolavirus, với tỷ lệ tử vong chừng 89%. Tiếp đến Sudanebolavirus cũng gây tử vong cao, từ 41% đến 65%.
Biểu hiện lâm sàng
Bệnh sử
Có 2 kiểu bệnh sử phơi nhiễm: nguyên phát và thứ phát.
Một bệnh sử phơi nhiễm nguyên phát thường liên quan đến đi du lịch hoặc làm việc trong một vùng Ebola virus lưu hành, như ở Cộng hòa Dân chủ Congo (DRC; trước đây là Zaire), Sudan, Gabon, hoặc Côte d’Ivoire. Một tiền sử phơi nhiễm với rừng châu Phi nhiệt đới hay gặp hơn ở các bệnh nhân phơi nhiễm nguyên phát với Ebola virus hơn là một tiền sử làm việc ở các thành phố trong cùng vùng.
Vì chưa phát hiện được ổ chứa tự nhiên của Ebola virus, cho nên chưa minh chứng được sự liên quan giữa phơi nhiễm cụ thể với các trung gian truyền bệnh của loài tiết túc (arthropod), động vật, hoặc các cây cỏ, thực vật có tiềm năng với bệnh. Bây giờ loài dơi được xem như một loài dự tuyển thích hợp, là nơi chứa virus trong thiên nhiên.
Phơi nhiễm thứ phát là phơi nhiễm người tới người, hoặc từ loài linh trưởng tới người. Ở mỗi vụ dịch chính, nhân viên y tế hoặc những người nhà chăm sóc bệnh nhân hoặc những người khâm liệm bệnh nhân tử vong để chôn cất có nguy cơ rất cao. Những nhân viên chăm sóc loài linh trưởng cũng có nguy cơ lây nhiễm. Nhóm này gồm những bệnh nhân đã trải qua kinh nghiệm nhiễm Restonebolavirus, vì có bằng chứng tạo kháng thể trong máu nhưng đã không biểu hiện lâm sàng bệnh Ebola virus.
Khám thực thể
Các biểu hiện thực thể tùy vào giai đoạn của bệnh tại thời điểm thăm khám bệnh nhân. Ở giai đoạn sớm của bệnh, bệnh nhân có thể biểu hiện sốt, viêm họng và các dấu hiệu, triệu chứng kinh điển nặng. Một ban dát sần, dễ dàng nhìn thấy ở bệnh nhân da trắng hơn là bệnh nhân da màu, có thể hiện hữu chừng 5 ngày sau nhiễm bệnh và chứng cớ rõ nét nhất ở thân người bệnh. Xung huyết kết mạc cũng hay gặp.
Ở giai đoạn muộn của bệnh, bệnh nhân thường có một vẻ mặt mất biểu cảm. Ở thời điểm này, hay gặp chảy máu tại các nơi tiêm truyền tĩnh mạch và niêm mạc. Đáng lưu ý rằng vụ dịch Ebola virus năm 1976, chảy máu được tìm thấy trong đa số trường hợp, trái lại vụ dịch Ebola virus năm 1995, chảy máu chỉ xảy ra 1/2 số bệnh nhân. Viêm cơ tim và phù phổi cũng gặp ở các giai đoạn muộn của bệnh. Cuối cùng bệnh nhân thường tử vong do khó thở nhanh, hạ huyết áp, vô niệu và hôn mê.
Bệnh cảnh lâm sàng
Người nhiễm loài Ebolavirus bắt nguồn từ châu Phi có đặc điểm về thời kỳ ủ bệnh điển hình từ 3 – 8 ngày ở các trường hợp nhiễm nguyên phát, dài hơn một chút trong các trường hợp nhiễm thứ phát. Tuy nhiên, cũng có những trường hợp thời kỳ ủ bệnh dài từ 19 – 21 ngày.
Các triệu chứng lâm sàng khởi phát đột ngột. Nhức đầu nặng (50% - 74%), đau khớp hoặc đau cơ (50% - 79%), sốt kèm theo hoặc không kèm theo lạnh run (95%), biếng ăn (45%) và liệt, nhược cơ thể (85% - 95%) xảy ra ở giai đoạn bệnh sớm.
Triệu chứng đường tiêu hóa gồm đau bụng (65%), buồn nôn và nôn (68% - 73%) và tiêu chảy (85%) xảy ra sớm. Chứng cớ liên quan đến niêm mạc gồm viêm kết mạc (45%), hoặc khó nuốt (57%) và chảy máu nhiều nơi khác nhau ở đường tiêu hóa. Chảy máu niêm mạc và các nơi tiêm chích gặp ở 40% - 50% bệnh nhân.
Phát ban ở bệnh nhân sống sót sẽ bong vảy suốt kỳ hồi phục, gặp ở 15% bệnh nhân. Cuối cùng bệnh nhân bị u ám, trì trệ, vô niệu, thở nhanh, thân nhiệt bình thường và rơi vào sốc.
Mặc dầu chưa rõ cơ chế, kết quả được ghi nhận ở các trường hợp tử vong trong cả hai vụ dịch năm 1976 và năm 1995 ở Cộng hòa Dân chủ Congo: Vụ dịch Ebola virus năm 1995 ở Kikwit, Cộng hòa Dân chủ Congo, thở nhanh là dấu hiệu khác biệt nhất để phân biệt những bệnh nhân còn sống (100% không khó thở) với những bệnh nhân tử vong (37% khó thở nhanh).
Các biến chứng
Các biến chứng về mắt 3/20 (15%) người sống sót trong vụ dịch năm 1995 ở Cộng hòa Dân chủ Congo. Các bệnh nhân đã báo cáo đau ở mắt, sợ ánh sáng, chảy nước mắt nhiều và giảm thị lực. Toàn bộ có bằng chứng tư liệu viêm màng bồ đào và tất cả đã được cải thiện khi dùng thuốc tra mắt (1% atropine và steroids).
Những bệnh nhân còn sống từ bệnh do Ebola virus cũng đã có những biểu hiện muộn như sau:
- Đau cơ.
- Đau khớp không đối xứng và di chuyển.
- Đau đầu.
- Mệt mỏi.
- Háu ăn.
- Vô kinh.
- Điếc.
- Ù tai.
- Viêm tinh hoàn một bên.
- Viêm tuyến mang tai sinh mủ.
Chẩn đoán phân biệt
Cân nhắc chẩn đoán
Sốt xuất huyết do Ebola virus cần được xem xét ở các bệnh nhân mới đây đi du lịch đến các vùng ở đó có mặt Ebola virus hoặc bệnh nhân từng bị phơi nhiễm với ca bệnh đã được biết và người biểu hiện dấu hiệu và triệu chứng phù hợp với nhiễm Ebola virus.
Mối quan tâm chính trong việc đối phó với nhiễm Ebola virus là tiềm năng lây lan của virus từ người tới người trước khi thực hiện chẩn đoán đúng. Nguy cơ này gồm những nhân viên y tế tiếp xúc trực tiếp bệnh nhân, máu, hoặc các chất dịch khác, hoặc các mô cơ thể của bệnh nhân. Những người nhà chăm sóc bệnh nhân hoặc người liên quan đến các nghi lễ chôn cất và tiếp xúc trực tiếp với cơ thể, máu, hoặc các chất dịch cơ thể khác cũng có nguy cơ cao nhiễm Ebola virus.
Ngoài các tình trạng bệnh lý được liệt kê trong chất đoán phân biệt, những trạng thái bệnh lý khác cũng được cân nhắc như sau:
- Tình trạng bụng cấp tính ngoại khoa (khi sốt xuất huyết do Ebola virus có các dấu hiệu về bụng).
- Sốt xuất huyết Crimean-Congo.
- Sốt xuất huyết Marburg.
- Các bệnh sốt xuất huyết do căn nguyên khác.
Cận lâm sàng
Các xét nghiệm máu cơ bản
Ở giai đoạn sớm, bệnh có đặc điểm giảm tiểu cầu, giảm bạch cầu đa nhân trung tính và giảm bạch cầu lympho nặng. Giảm bạch cầu đa nhân trung tính xảy ra vài ngày, khi tăng AST và ALT. Bilirubin có thể bình thường hoặc tăng nhẹ.
Với khởi phát vô niệu, urea máu và creatinine huyết thanh tăng lên. Cuối cùng tất cả bệnh nhân có thể xuất hiện toan chuyển hóa, có thể góp phần gây khó thở nhanh, có thể là một cố gắng để tăng thông khí bù trừ.
Phân lập virus
Chẩn đoán xác định dựa lên sự phân lập virus bằng các phương tiện cấy mô hoặc thử nghiệm RT-PCR. Tuy nhiên việc phân lập Ebola virus bằng nuôi cấy mô là một thủ thuật nguy cơ cao mà chỉ có thể thực hiện được một cách an toàn ở một vài phòng thí nghiệm có độ an toàn cao trên thế giới.
Kiểm định huyết thanh để tìm kháng thể và kháng nguyên
Test kháng thể huỳnh quang gián tiếp (IFAT) được kết hợp với các kết quả dương tính giả. Những mối quan tâm về độ nhạy và tính hữu ích của test này đã tạo kết quả trong việc phát triển các test huyết thanh xác định. Ở bệnh nhân bị nhiễm sống sót đủ lâu để phát triển một đáp ứng miễn dịch, các test ELISA – IgM và – IgG có thể là hữu ích trong chẩn đoán nhiễm Ebola virus. Cả hai test ELISA đã được thể hiện là nhạy cảm và đặc hiệu.
IgM-capture ELISA dùng kháng nguyên Zaireebolavirus phát triển trong tế bào Vero E6 để phát hiện các kháng thể IgM đối với dòng virus này. Các kết quả trở nên dương tính ở các loài linh trưởng thực nghiệm trong vòng 6 ngày bị nhiễm, nhưng không duy trì dương tính trong các thời kỳ được mở rộng. Những chất lượng này biểu thị rằng test IgM có thể được dùng để dẫn chứng bằng tài liệu về nhiễm Ebola virus cấp.
IgG-capture ELISA dùng các kháng nguyên virus được tách chiết bằng chất tẩy rửa để phát hiện các kháng thể kháng Ebola virus dòng IgG. Test này đặc hiệu hơn IFAT và nó vẫn còn dương tính suốt những thời kỳ dài. Một cách thích hợp, dường như test này cao hơn để thực hiện điều tra về tỷ lệ hiện mang huyết thanh dương tính.
Một test ELISA phát hiện kháng nguyên để phát hiện kháng nguyên Ebola virus.
Các xét nghiệm khác
Các nguy cơ trong việc phân lập virus đã dẫn đến sự phát triển các kiểu xét nghiệm khác nhau để xác định tốt hơn đối với các phòng thí nghiệm có các hệ thống bảo quản an toàn hạn chế. Các tests được dùng để xác định chẩn đoán nhiễm Ebola virus gồm một test hóa mô miễn dịch được thực hiện trên các ca tử vong được cố định bằng formalin được thu thập từ bệnh nhân bị tử vong do sốt xuất huyết Ebola virus. Test này an toàn, nhạy và đặc hiệu, nó có thể được dùng để chẩn đoán và giám sát.
Kính hiển vi điện tử đã được dùng để phân lập filoviruses trong mô nhưng rõ ràng có những hạn chế về cách thức chẩn đoán trong các vùng ở đó những vụ dịch ở người đã từng xảy ra. Không sẵn có ở các vùng có Ebola virus lưu hành.
Các dữ liệu tổ chức học
Mặc dầu có khả năng liên quan đến nhiều mô, Ebola virus có một ái tính với tế bào nội mạc mạch máu, tế bào gan và tế bào đơn nhân thực bào. Sự nhân lên của virus được kết hợp với những ổ hoại tử lan rộng và hầu hết là nặng ở gan, lách, hạch bạch huyết, thận, phổi và cơ quan sinh dục.
Ở gan, những giọt nhỏ bắt màu eosin từ ổ hoại tử của các tế bào gan (giống các thể Councilman), tương tự như những thể được tìm thấy trong bệnh sốt vàng, là phổ biến. Tuy nhiên, hoại tử ổ được kết hợp với sự nhân lên của Ebola virus tạo kết quả trong một đáp ứng viêm hiệu lực tối thiểu. Ở giai đoạn muộn của bệnh, niêm mạc tiêu hóa có thể tách khỏi lớp lamina propria và vảy mục.
Điều trị và quản lý
Các khái niệm chung
Hỗ trợ y tế nói chung là quan trọng và phải gồm thay thế các yếu tố đông máu và heparin nếu có sự phát triển đông máu rải rác nội mạch. Việc chăm sóc như thế cần được quản lý với việc cách ly bệnh nhân chặt chẽ. Tất cả dịch cơ thể (máu, nước bọt, nước tiểu và phân) chứa các hạt virus gây lây nhiễm phải được quản lý hết sức cẩn thận.
Hiện chưa có sẵn điều trị đặc hiệu hiệu lực. Nói chung can thiệp phẫu thuật sau một trường hợp chẩn đoán nhầm các dấu hiệu thực thể về bụng do nhiễm Ebola virus với một trường hợp cấp cứu bụng ngoại khoa. Một nhầm lẫn như thế có thể gây tử vong bệnh nhân và dễ gây phơi nhiễm với bất kỳ thành viên nào của đội phẩu thuật do bị phơi nhiễm với máu bệnh nhân.
Chưa sẵn có vaccine Ebola virus trên thị trường. Tuy nhiên, kháng thể đơn dòng người tái tổ hợp đã trực tiếp chống lại glycoprotein vỏ Ebola virus đã biểu thị có hoạt tính trung hòa. Kháng thể trung hòa Ebola virus có thể có hữu ích trong việc phát triển vaccine hoặc với tư cách của một vaccine phòng ngừa thụ động. Việc nghiên cứu vaccine đang được tiếp tục.
Chăm sóc hỗ trợ
Điều trị hỗ trợ cần chú ý đến thể tích nội mạch, điện giải đồ, chất dinh dưỡng và các chăm sóc tiện ích có lợi. Bù đủ thể tích nội mạch là một trong các biện pháp hỗ trợ quan trọng nhất.
Các bệnh nhân sống sót có thể tạo các tiểu thể virus gây nhiễm trong một thời kỳ lâu dài. Do đó, cách ly bệnh nhân đã hồi phục chặt chẽ trong một phòng riêng cách xa các dạng lưu thông phải được duy trì trong suốt thời kỳ hồi phục. Nước tiểu, phân, đờm và máu bệnh nhân cùng với bất kỳ vật thể nào khác mà đến từ tiếp xúc với bệnh nhân hoặc các dịch cơ thể của bệnh nhân (chẳng hạn như thiết bị thí nghiệm), phải được khử khuẩn với dung dịch 0,5% sodium hypochlorite. Bệnh nhân tử vong do bệnh Ebola virus phải được chôn cất nhanh, đúng quy trình và giảm thiểu sự tiếp xúc với thi thể bệnh nhân nếu có thể.
Điều trị bằng thuốc
Các chất ức chế tương tự nucleoside của enzyme mã hóa tế bào S-adenosylhomocysteine hydrolase (SAH) đã được cho thấy để ức chế sự nhân lên của Zaire ebolavirus ở chuột BALB/c trưởng thành được gây nhiễm với Ebola virus được thích ứng với chuột thí nghiệm. Sự ức chế của SAH ức chế gián tiếp các phản ứng transmethylation cần cho sự nhân lên virus. Đáp ứng điều trị tùy thuộc liều thuốc. Khi liều thuốc 0,7mg/kg hoặc nhiều hơn mỗi 8 giờ đã được bắt đầu và ngày 0 hoặc ngày 1 của sự nhiễm virus, tỷ lệ tử vong đã được phòng ngừa hoàn toàn. Thậm chí khi thuốc được dùng vào ngày thứ 2 thì có đến 90% người không bị tử vong.
Smith và cộng sự đã tìm thấy rằng ở khỉ rhesus bị nhiễm với một liều Ebola virus chí tử, điều trị sớm với interferon-beta sau phơi nhiễm dẫn đến một sự tăng lên có ý nghĩa về thời gian sống sót, mặc dầu nó không giảm tỷ lệ tử vong có ý nghĩa. Các dữ liệu này gợi ý rằng trị liệu bằng interferon-beta sớm sau phơi nhiễm có thể là một trị liệu hổ trợ hứa hẹn trong điều trị.
Miễn dịch thụ động từng được thử bằng cách dùng các chế phẩm globulin miễn dịch cao dẫn xuất từ ngựa và globulin miễn dịch giai đoạn hồi phục dẫn xuất từ người. Ở loài khỉ cynomolgus nhiễm Ebolavirus, việc dùng interferon alfa-2b người tái tổ hợp liên kết với IgG ngựa miễn dịch cao đã làm chậm nhưng đã không ngăn ngừa tử vong.
IgG ngựa chứa các kháng thể trung hòa chuẩn độ cao với Ebola virus đã bảo vệ được guinea pigs và khỉ đầu chó nhưng không hiệu lực trong việc bảo vệ các khỉ rhesus bị nhiễm.
Suốt vụ dịch năm 1995 ở Kikwit, Cộng hòa Dân chủ Congo, huyết tương người ở giai đoạn bệnh hồi phục đã được dùng để điều trị 8 bệnh nhân mắc bệnh Ebola virus đã được chứng minh và chỉ 1 bệnh nhân tử vong. Những nghiên cứu kế tiếp có thể không biểu hiện về lợi ích sống sót có được từ việc dùng các sản phẩm huyết thanh bệnh nhân ở giai đoạn hồi phục. Sự sống sót của những bệnh nhân này gợi ý rằng miễn dịch thụ động có thể có lợi ở một số bệnh nhân.
Bốn nhân viên phòng thí nghiệm ở Nga có thể có sự phơi nhiễm với Ebola virus đã được điều trị với một hỗn hợp immunoglobulin kháng Ebola virus được chiết suất từ dê kèm theo với interferon alfa-2 người tái tổ hợp. Một trong số các bệnh nhân này có một phơi nhiễm nguy cơ cao và đã phát triển triệu chứng lâm sàng của nhiễm Ebola virus. Tất cả 4 bệnh nhân đều khỏi bệnh.
Một kháng thể đơn dòng người tái tổ hợp đã trực tiếp chống lại glycoprotein vỏ Ebola virus đã được biểu thị để có hoạt tính trung hòa. Kháng thể trung hòa Ebola virus này có thể là hữu ích trong việc phát triển vaccine hoặc với tư cách là vaccine dự phòng thụ động.
Các vaccine DNA biểu thị hoặc là glycoprotein vỏ hoặc là gene của nucleocapsid protein Ebola virus đã được biểu thị để gây cảm ứng sự bảo vệ ở chuột nhắt trưởng thành được phơi nhiễm với virus này. Các vaccines này đã được quản lý bằng cách bọc những hạt bằng vàng với DNA biểu thị các genes đối với hoặc glycoprotein hoặc nucleocapsid protein và chúng được chuyển giao bằng sự bắn vào tiểu thể da bằng cách dùng một súng bắn gene kiểu PowderJect-XR. Cả hai vaccines đã gây cảm ứng những đáp ứng kháng thể có thể đo đạc được đã được phát hiện bằng ELISA và đã gây cảm ứng miễn dịch tế bào T gây độc tế bào.
Các điều trị thực nghiệm khác mà dùng các thuốc có sẵn, mặc dầu chưa được cơ quan FDA Hoa Kỳ thừa nhận để điều trị nhiễm Ebola virus có thể được xem xét. Những thuốc mà có thể giảm tỷ lệ tử vong không tác dụng trực tiếp lên sự nhân lên của virus gồm cả protein C được hoạt hóa và một protein kháng đông máu của loài giun tròn tái tổ hợp (NAP) mà ức chế phức hợp yếu tố mô, yếu tố VII bị hoạt hóa. NAP đã tạo kết quả trong việc ngăn cản hiện tượng đông máu được kết hợp với tiêu fibrin và sự đọng lại của fibrin bị giảm với một sự giảm kết quả trong sự nghiêm trọng của hội chứng đáp ứng viêm toàn thân.
Trong một mô hình khỉ rhesus của bệnh sốt xuất huyết do Ebola virus, mà có một tỷ lệ tử vong gần 100%, Geisbert và cộng sự đã dùng protein kháng đông của loài giun tròn tái tổ hợp, một chất ức chế mạnh của hiện tượng đông máu được TF khởi động. Một phần ba số khỉ được dùng protein kháng đông của loài giun tròn tái tổ hợp đã sống sót với liều Ebola virus chí tử, trái lại 16/17 (94%) các động vật nhóm chứng đã chết. Phương pháp này đã nhằm vào thành phần cấu thành bệnh sốt xuất huyết của sự nhiễm hơn là nhằm vào chính bản thân virus.
Phòng bệnh
Công trình tiếp tục một vaccine đối với nhiễm Ebola virus ở loài linh trưởng. Sullivan và cộng sự đã báo cáo về sự kết hợp của vaccine DNA thuần túy có khả năng mã hóa các protein của Ebola virus được theo bởi một sự chủng ngừa tăng cường với một vật trung chuyển (vector) adenovirus tái tổ hợp biểu thị GP của Ebola (Z).
Trong nghiên cứu này, loài khỉ cynomolgus được tiêm với 3 liều vaccine DNA, 1 liều cho mỗi 4 tuần. Mười hai tuần sau, các khỉ này được tiêm vector adenovirus tái tổ hợp. Sau 12 tuần khác, các khỉ không được tiêm và được tiêm đã được tiêm một liều Ebola virus chí tử. Tất cả những khỉ không được têm đều chết, Trái lại khỉ được tiêm không một con nào chết cả.
Công trình này biểu thị rằng loài linh trưởng được tiêm chống lại được Ebola virus và có thể phát triển cả một đáp ứng trung gian tế bào (được nghĩ là kết quả của vaccine DNA) và một đáp ứng kháng thể thể dịch (người ta nghĩ là do vaccine adenovirus tái tổ hợp).
Những cố gắng khác để thiết kế vaccines mà hoạt động ở loài linh trưởng đã dùng các chiến lược mà là thành công ở chuột và loài guinea pigs. Geisbert và cộng sự đã nghiên cứu một loạt các vaccines chứa các tiểu thể RNA replicon từ một dòng virus gây viêm não ngựa ở Venezuela đã giảm độc lực mà đã biểu thị GP và NP của Ebola virus, một virus vaccinia tái tổ hợp mà biểu thị GP của Ebola virus, liposomes chứa lipid A và Ebola virus bị bất hoạt và một chế phẩm toàn bộ hạt Ebola virus được cô đặc, bị bất hoạt.
Mặc dầu những vaccine này đã bảo vệ loài gặm nhấm chống lại Ebola virus khi được gây nhiễm, chúng không bảo vệ loài khỉ cynomolgus hoặc khỉ rhesus chống lại sự phơi nhiễm với virus này.
Ebola virus có thể lây truyền từ người qua người theo đường tiếp xúc trực tiếp với máu hoặc các dịch cơ thể khác của một người bị nhiễm. Sự truyền nhiễm qua đường không khí của Restonebolavirus được biết đã từng xảy ra ở loài linh trưởng. Do đó, mặc dầu hầu hết trường hợp ở người xảy ra sau khi tiếp xúc trực tiếp với một bệnh nhân hoặc máu, các dịch khác của họ, sự lây truyền Ebola virus qua đường không khí không thể bị loại trừ.
Kiểm soát việc lây nhiễm bên trong và bên ngoài các cơ sở y tế nhờ vào hàng rào bảo vệ bằng cách dùng găng tay 2 lớp, áo quần bảo hộ không thấm dịch, mạng nhựa trong che mặt bảo vệ mắt, vải phủ chân và cẳng tay.
Theo John W. King; Ebola virus infection;
Medscape updated: Aug 19, 2014.
PVPQHTN914



